Dla lekarzy
Metoda maintrac®
Wykrywanie CETCs polega na ocenie antygenu adhezyjnego komórek nabłonkowych (ang. epithelial cell adhesion molecule-EpCAM). Antygen ten nie występuje fizjologicznie na nienowotworowych komórkach obecnych we krwi. Metoda oznaczająca ilościowo krążące nabłonkowe komórki nowotworowe (CETC) jest wysoce powtarzalna, akredytowana i zwalidowana zgodnie z normą DIN EN ISO 15 189. Wyniki badań wielokrotnie publikowaliśmy w międzynarodowych czasopismach branżowych i naukowych.
Wykrywanie CTCs we krwi obwodowej jest przedmiotem licznych badań na całym świecie. Jedną z takich metod, którą opracowaliśmy w naszym laboratorium to metoda maintrac. Wykrywanie CTCs opiera się na ocenie antygenu adhezyjnego komórek nabłonkowych (ang. epithelial cell adhesion molecule-EpCAM). Antygen ten nie występuje fizjologicznie na nienowotworowych komórkach obecnych we krwi. Oznaczamy komórki w krwi pobranej na EDTA. Badanie akredytowalismy zgodnie z normą DIN EN ISO 15 189. Wyniki badań publikujemy w czasopismach branżowych na całym świecie.
Ligand receptora programowanej śmierci 1 (PD-L1)
Interakcja cząsteczek PD-1 (ang. programmed death 1) i PD-L1 (ang. programmed death ligand 1) doprowadza do wygaszenia aktywności przeciwnowotworowej limfocytów T. Idea immunoterapii z wykorzystaniem przeciwciał przeciwko immunologicznym punktom kontroli opiera się na zablokowaniu jednej z tych cząsteczek, co przywraca aktywność cytotoksyczną limfocytów T.
Oznaczanie poziomu ekspresji PD-L1 (Ligand receptora programowanej śmierci-1) na komórkach nowotworowych krążących we krwi pacjentów jest istotne z kilku powodów w kontekście leczenia nowotworów:
Wybór odpowiedniej terapii: Pomaga lekarzom ocenić, czy pacjent może być kandydatem do terapii blokowania PD-L1. Jeśli komórki nowotworowe wykazują wysoki poziom ekspresji PD-L1, istnieje większa szansa na skuteczność terapii przeciwciałem anty-PD-L1 lub przeciwciałem anty-PD-1.
Przewidywanie skuteczności terapii: Wyższy poziom PD-L1 w nowotworze może wskazywać na większą skuteczność terapii blokowania PD-L1/PD-1. Jednak terapie te nie są zawsze skuteczne, nawet jeśli PD-L1 jest obecne, więc jest to jedno z wielu kryteriów oceny skuteczności leczenia.
Monitorowanie odpowiedzi na leczenie: Badanie poziomu PD-L1 przed i w trakcie leczenia może pomóc ocenić, czy terapia działa. Zmiany w ekspresji PD-L1 po leczeniu mogą dostarczać informacji o tym, czy nowotwór jest bardziej podatny na terapię.
Prognozowanie przeżycia: Niektóre badania sugerują, że poziom PD-L1 może być związany z rokowaniem pacjenta. Wyższy poziom PD-L1 może być skorelowany z gorszym rokowaniem w niektórych przypadkach, choć jest to zależne od rodzaju nowotworu.
Oznaczenie PD-L1 w krążących komórkach nowotworowych może pomóc w ustaleniu strategii leczenia z zastosowaniem immunoterapii i leków biologicznych (przeciwciał) atezolizumab, nivolumab i pembrolizumab.
Im wyższa ekspresja PD-L1 na komórkach nowotworowych tym odpowiedź na leczenie lekami immunologicznymi jest większa.
Czasami badania PD-L1 zleca się w przypadku ponownego rozrostu raka po chemioterapii lub innym sposobie leczenia. Można je również zlecić u pacjenta w zaawansowanym stadium nowotworu, w którym pozostało niewiele opcji leczenia, kiedy rozpatruje się immunoterapię PD-L1.
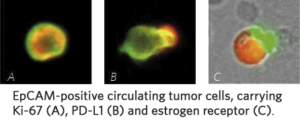
Oznaczenia PD-L1 można wykorzystywać jako pomoc w leczeniu następujących nowotworów:
- Niedrobnokomórkowy rak płuc
- Rak piersi
- Rak pęcherza moczowego oraz nowotwory nabłonka przejściowego
- Gruczolakorak żołądka, wpustu żołądka oraz rak kolczystokomórkowy przełyku
- Rak kolczystokomórkowy głowy i szyi
- Rak szyjki macicy
- Czerniak
Badanie można wykonać jako uzupełniające oznaczenie do testu Maintrac. Czas oczekiwania na wynik badania to 7 dni roboczych od momentu otrzymania próbki.
Charakterystyka receptorowa guza
Decyzję o terapii należy w miarę możliwości dostosować do konkretnego pacjenta i jego raka.
Niektóre substancje (ukierunkowane terapie przeciwnowotworowe) okazują się jednak przydatne tylko wtedy, gdy guz wykazuje określone właściwości. Na przykład pacjenci z rakiem piersi mogą otrzymać leczenie specjalnymi przeciwciałami, jeśli mają komórki HER2 / neu dodatnie. Jako takie, badanie tkanki guza lub guza pierwotnego jest już uważane za rutynowe w nowoczesnym planowaniu terapii.
Maintrac® może określić charakterystyczne cechy związane z terapią poprzez testy przeprowadzone bezpośrednio na krążących komórkach nowotworowych we krwi. W ten sposób maintrac® może pomóc w znalezieniu odpowiedniego rodzaju terapii, nawet w sytuacjach, gdy pierwotny guz został już chirurgicznie usunięty lub guz jest niedostępny. Komórki nowotworowe mają szybki podział komórek. Podczas tych cykli podziału komórek często zmieniają swoje właściwości. Zmiany te mogą wpływać na właściwości powierzchni, a także ekspresję genów lub DNA komórek w komórkach nowotworowych. Zmiany te mogą wpływać na odpowiedź komórek nowotworowych na zastosowane podejście terapeutyczne, co często oznacza, że regularne testowanie tych właściwości maintrac® może mieć pozytywny wpływ na wskaźnik powodzenia leczenia.
W przypadkach „raka z nieznanym guzem pierwotnym” zwykle stosuje się różne testy (np. Biopsje) do testowania przerzutów w celu ustalenia pochodzenia guza pierwotnego. Niemniej jednak przerzuty często mogą być trudne do osiągnięcia. Jednak często uwalniają komórki do krwi, podobnie jak związany z nimi guz pierwotny. „Płynna biopsja”, która bada te komórki w ramach analizy maintrac®, przyczynia się do identyfikacji guza pierwotnego poprzez określenie pewnych właściwości krążących komórek nowotworowych.
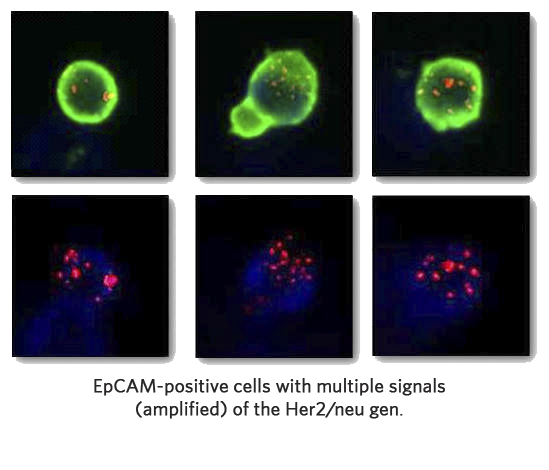
Przykłady znaczenia właściwości komórek nowotworowych związanych z terapią.
W przypadku następujących rodzajów terapii celowanej właściwości CETC / CTC odgrywają ważną rolę:
- Blokowanie receptorów hormonalnych, takich jak receptory estrogenowe lub androgenowe.
- Terapie przeciwciałami skierowanymi przeciwko cząsteczkom na powierzchni komórki, np. HER2 / neu.
- Terapie z udziałem tak zwanych „małych” cząsteczek, które blokują przekazywanie sygnału przez receptory.
- Określenie odsetka komórek rosnących lub „uśpionych”, ponieważ może to również mieć wpływ na terapię (szybko rosnące komórki są leczone innymi lekami niż komórki „uśpione” lub bardzo wolno rosnące).
- Określenie pochodzenia raków niewiadomego pochodzenia (ACUP) poprzez określenie cech krążących komórek nowotworowych.
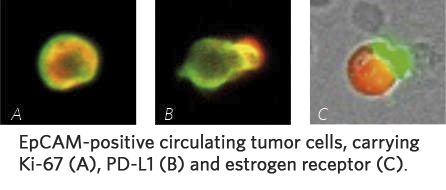
Ki67 jest białkiem jądrowym związanym z proliferacją komórek. Białko Ki67 jest obecne podczas wszystkich aktywnych faz cyklu wzrostu, ale nie występuje w komórkach spoczynkowych (spoczynkowych). Ki67 identyfikuje się metodą IHC. Obecność białka Ki67 na krążących komórkach nowotworowych wskazuje procent krążących komórek nowotworowych w aktywnej fazie wzrostu cyklu komórkowego. Wyższe ilości wiążą się ze zwiększonym ryzykiem progresji lub nawrotu. Krążące razem komórki nowotworowe i ki67 stanowią bardzo przydatne narzędzie do monitorowania skuteczności leczenia i ryzyka progresji choroby
Mavroudis D., Agelaki S. Jounal z Clinical Oncology, 34,15.2017 – Związek ekspresji Ki-67 w CTC z nawrotem choroby…
Wysoka ekspresja Ki67 – zwiększone ryzyko progresji
Dwa poniższe przykłady pochodzą od pacjentów po wstępnej operacji guza pierwotnego plus leczenie uzupełniające. Zidentyfikowana liczba krążących komórek nowotworowych jest niska, ale ekspresja Ki67 jest wysoka, co wskazuje na zwiększone ryzyko progresji.
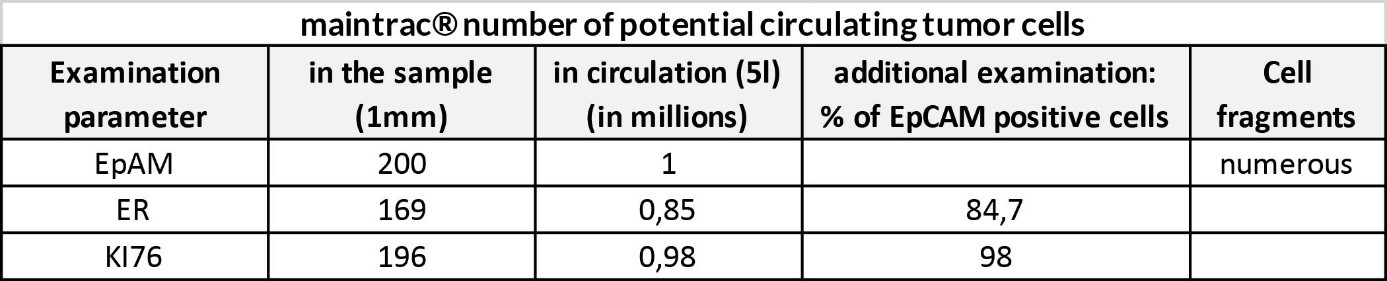
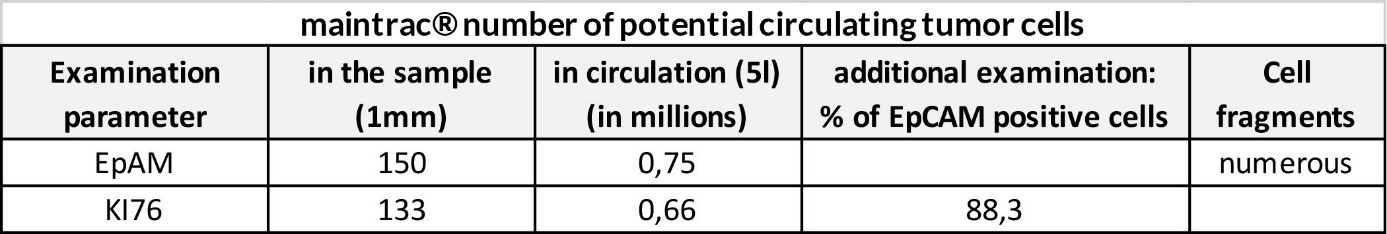
Wniosek:
Należy ściśle monitorować liczbę krążących komórek nowotworowych i ocenę kliniczną.
Maintrac to innowacyjna platforma analityczna w diagnostyce raka i monitorowaniu terapii. Maintrac identyfikuje i ocenia ilościowo krążące komórki nowotworowe w próbce krwi pacjentów z rakiem i analizuje skuteczność wybranych leków. W badaniach klinicznych z udziałem ponad 900 pacjentów maintrac wykazał, że monitorowanie krążących komórek nowotworowych w sytuacji adiuwanta, podczas leczenia podtrzymującego i leczenia przeciwciałem w raku piersi ma znaczące korzyści. Możliwe nawroty można rozpoznać na wczesnym etapie
Stemtrac
Metodologia i charakterystyka
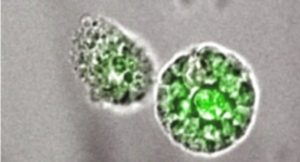
Test stemtrac polega na hodowli in vitro krążących macierzystych komórek nowotworowych obecnych we krwi pacjenta cierpiącego na nowotwór. Pozwala na identyfikację macierzystych komórek nowotworowych zdolnych do proliferacji w ciągu 2–3 tygodni.
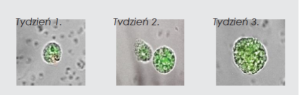
W wyniku hodowli powstają sferyczne struktury o średnicy 30–100 μm, zwane sferami/sferoidami. Składają się one z komórki-matki i mogą zawierać maksymalnie 100 komórek potomnych.
Znaczenie kliniczne
U pacjentek z rakiem piersi, ilość sfer ścisłe koreluje ze stadium choroby. W przypadku zaawansowanego stadium choroby duża cześć krążących komórek nowotworowych mogą stanowić macierzyste komórki nowotworowe. Badając grupę osób zdrowych (grupa kontrolna) nie zaobserwowano wzrostu sferoidow.
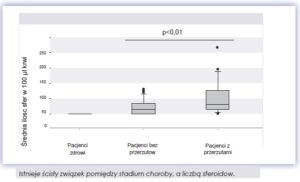
Po oznaczeniu obecności więcej niż 300 sferoidow w jednym mililitrze krwi, zalecane jest przeprowadzenie dalszej diagnostyki obrazowej w celu zidentyfikowania obecności ewentualnych przerzutów.
W szczególności w przypadku pacjentów z obecnością zmian przerzutowych, korzystna może okazać się optymalizacja leczenia, jeżeli we krwi zostanie wykryta duża ilość sfer. Celem leczenia nowotworu jest nie tylko zmniejszenie liczby krążących komórek nowotworowych, ale również redukcja liczby krążących macierzystych komórek nowotworowych zdolnych do proliferacji i tworzenia przerzutów.
Oznaczanie Krążących Macierzystych Komórek Nowotworowych.
Rozpatrywany przypadek 60-letniej pacjentki z rakiem piersi. Zdiagnozowano u niej raka piersi estrogenowo dodatniego z przerzutami do kości.
Leczenie polegało na chirurgicznym usunięciu guza raka piersi, radioterapii przerzutów do kości i terapii hormonalnej. Ponadto aktywne i interwencyjne uzupełniające leczenie, w tym odżywianie, styl życia, suplementy.
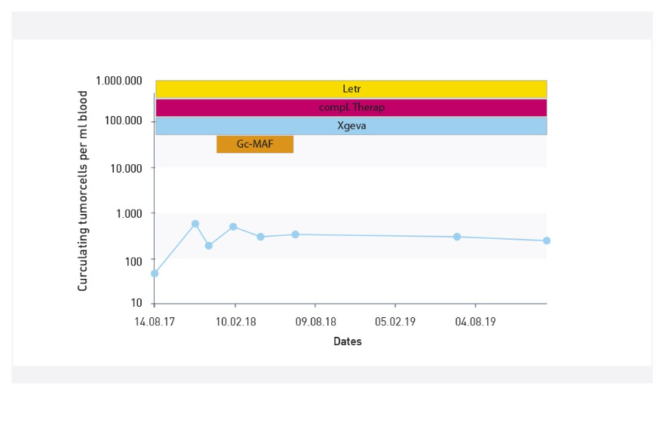
Liczba CTC pozostała umiarkowanie podwyższona pomimo intensywnych i połączonych terapii, w tym terapii komórkami dendrytycznymi. Ostatni przegląd kliniczny wskazał na stabilną chorobę.
Testy sfer nowotworowych rozpoczęto w celu określenia agresywności i zwiększonego ryzyka dalszego rozwoju przerzutów.
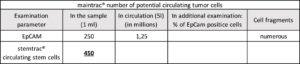
CTC uległy zmianie i wykazują mniejszą ekspresję receptora EpCam. Liczba sfer nowotworowych wynosząca 450 sfer/ml wskazuje na wzrost agresywności komórek nowotworowych i zwiększenie ryzyka dalszego rozwoju przerzutów.
Krew pacjenta inkubuje się w specjalnych pożywkach a następnie obserwuje wzrost sfer nowotworowych. Sfery poddaje się barwieniu EpCAM by potwierdzić nowotworowe pochodzenie.
Opcja terapeutyczna
Pacjentkę należy monitorować w cyklach co 3 miesiące by wychwycić możliwe przeżuty.
Maintrac to innowacyjna platforma analityczna w diagnostyce raka i monitorowaniu terapii. Maintrac identyfikuje i ocenia ilościowo krążące komórki nowotworowe w próbce krwi pacjentów z rakiem i analizuje skuteczność wybranych leków. W badaniach klinicznych z udziałem ponad 900 pacjentów Maintrac wykazał, że monitorowanie krążących komórek nowotworowych w sytuacji adiuwanta, podczas leczenia podtrzymującego i leczenia przeciwciałem w raku piersi ma znaczące korzyści dla prowadzenia leczenia. Możliwe nawroty można rozpoznać na wczesnym etapie.
Metodologia
Ze względu na wysoką czułość zastosowanych technik, CETC / CTC są możliwe do wykrycia wkrótce po zdiagnozowaniu pierwotnego guza, a decyzję o terapii można podjąć w odpowiednim czasie. Czułość testu maintrac® opiera się na analizie krwi w czasie rzeczywistym. Test jako jedyny pozwala na wykrycie żywych komórek nowotworowych. Odróżnia go to do innych metod, w których komórki są utrwalane, izolowane lub wzbogacane. Dzięki niskiemu progowi detekcji oznaczenie CETC / CTC jest możliwe nawet we wczesnych stadiach choroby, a nie tylko po osiągnięciu stadium przerzutowego.
Oprócz krążących komórek nabłonkowych, we krwi znajdują się również białe krwinki (leukocyty). Po lizie erytrocytów (rozpad czerwonych krwinek) krew testuje się na obecność komórek nabłonkowych. Na powierzchni komórek nabłonkowych można znaleźć białko powierzchniowe komórki (EpCAM). Znakowane w procesie maintrac® przy użyciu przeciwciała fluorescencyjnego świeci na zielono. Antygen ten nie występuje fizjologicznie na nienowotworowych komórkach obecnych we krwi.
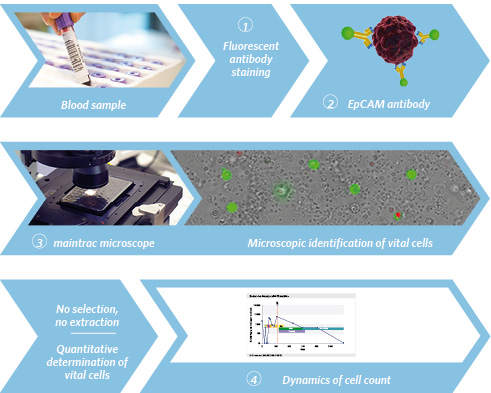
Jednocześnie dodaje się jodek propidyny, który przenika przez błonę komórkową martwych komórek. Umożliwia to odróżnienie martwych komórek (zabarwionych na czerwono / zielono) od żywych komórek nowotworowych (zabarwionych na zielono).
Za pomocą mikroskopu fluorescencyjnego oznaczone komórki można teraz automatycznie zidentyfikować i policzyć.
Kilkukrotne wykonanie w określonych odstępach czasu testu maintrac® , pozwala na monitorowanie terapii i aktywności nowotworu w trakcie postępu choroby pacjenta. Badanie ma zastosowanie w czasie terapii przeciwnowotworowej jak jako narzędzie do wczesnego wykrywania wznowy po zakończeniu procesu leczenia.
Kontakt
Masz pytania? Jesteśmy tu po to, żeby Tobie pomóc. Zadzwoń lub użyj poniższego formularza!
Zadzwoń
+48 *** *** ***
Napisz maila
pomocrak@protonmail.com